[談疫情] 誤導的話術
我老婆常常跟我說,我最讓她討厭的一點,就是我很會抓人家語病.
沒辦法,因為很多人講話會在話語中佈下陷阱,用話術有意無意誤導他人.我很笨,所以只好注意文字中的語病,以免被誤導了.
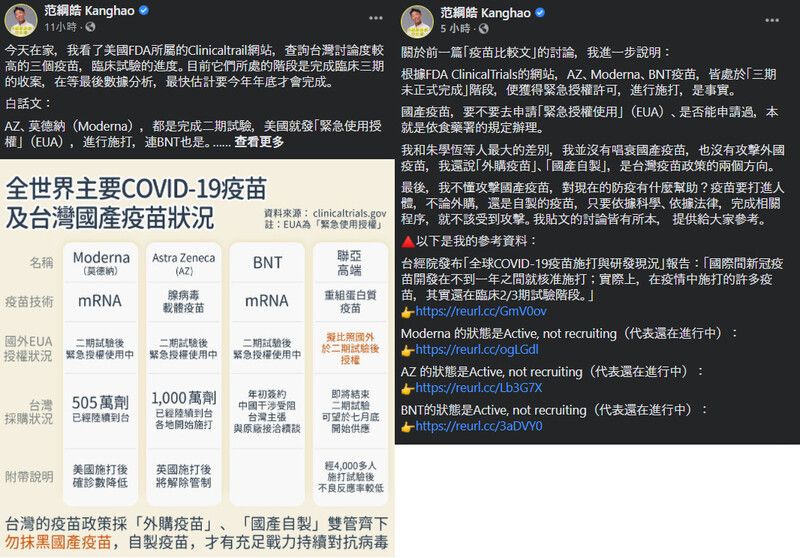
譬如說這兩天很熱門的范先生吧,他在臉書上發了一張圖表,說幾個熱門新冠疫苗在"二期試驗後緊急授權使用中",所以國產疫苗也會比照如此.
這就是個話術.
等到被質疑了,他發出另一篇文章,說那些疫苗應該是處於「三期未正式完成」,並獲得緊急授權許可,進行施打,是事實.
這,也是話術.
兩段話,沒完全錯誤,也沒完全正確.
第一段話,會誤導讀者以為那些疫苗並沒有進行三期試驗,因為「二期試驗後緊急授權使用中」的說法,會讓人以為「沒有進行三期」.
實際上,這些外國疫苗全都有進行三期試驗,因為這是必要程序.
就像我生日的時候,我都跟人家說:「我今年滿20歲」.
這沒錯啊,如果我今年35歲的話,的確滿了20歲,也滿了30歲就是了.
等到網路上陸續提出那些疫苗進行三期試驗的證據時,他的第二段話說那些疫苗「三期未正式完成」,並獲得緊急授權許可.
這點說明了第一段話他說的沒錯,同時又講了一個事實,就可以反證他第一段話沒有說謊.
可是這個事實,並不是完全的事實.
所以才說這是一個誤導的話術.
所謂的緊急授權EUA,是美國FDA對於醫藥上市的審核程序的一個緊急程序,讓可以救命的醫藥疫苗能夠縮短審核時程,提早上市.
但是!!醫藥聲請上市應該進行的一二三期試驗,並沒有省略,只是在時間上放寬標準.
譬如說三期試驗本該有個一到四年的試驗期,EUA放寬為三期試驗只要有至少一半以上的志願者在完整接種之後,再經過兩個月的觀察追蹤的資料,就能提出申請.
原文是這樣:「phase 3 data will include a median follow-up of at least 2-months (meaning that at least half of vaccine recipients in phase 3 clinical trials have at least 2 months of follow-up)」
各大廠商為了搶時間上市,只要累積資料達到要求,就會邊送出申請邊繼續試驗追蹤.
比方來說,這就有點像是你大學本來要修四年,可是學校規定如果學分修到某個程度,成績又非常優秀,就可以申請提早一年畢業;
所以你會繼續修原本應該要修的學分,一邊提出申請,如果申請通過了,那就少修一年,如果申請沒過,那就乖乖地唸個四年.
這些疫苗會提出EUA,當然就是不要把三期試驗做完四年的期限,而是要照著EUA的規定來緊急授權提早上市.
既然通過EUA,就表示所有資料,包含三期試驗,都通過檢核標準
所以范先生說這些疫苗都還在進行三期試驗,沒錯,但是他們的三期試驗都已經達到EUA的最短時程要求.
而且重點是:這些疫苗都有實施三期試驗.
輝瑞的高層針對疫苗的有效性時曾說的:只有通過三期實驗的考驗,這疫苗才算是成功.
且讓我再次引述當時在研發疫苗的九家大藥廠聯合發表聲明的標題:「Stand With Science」.
疫苗這件事情,就讓科學來吧.
至於有人要撻伐范先生說謊之類的,那大概是沒辦法成立的.
他說的「二期試驗後緊急授權使用中」,可以辯稱「緊急授權是在三期試驗中通過的,而三期試驗的確是在二期試驗後啊,我並沒講沒進行三期試驗,是你們自己望文生義想太多了」.
話術啊,話術.
-----
參考連結:
* FDA核准輝瑞疫苗採用EUA程序的審核備忘錄(review memo) <- 這個不僅針對輝瑞疫苗,而且也說明了EUA的程序,如果沒有時間,看這個就夠了:
https://www.fda.gov/media/144416/download
* FDA 緊急授權 Emergency Use Authorization:
* FDA 藥品研究過程之第三期實驗程序:
https://www.fda.gov/patients/drug-development-process/step-3-clinical-research
* FDA對疫苗的緊急授權說明 Emergency Use Authorization for Vaccines Explained:
https://www.fda.gov/vaccines-blood-biologics/vaccines/emergency-use-authorization-vaccines-explained
(原發布於2021.06.01)
喜欢我的作品吗?别忘了给予支持与赞赏,让我知道在创作的路上有你陪伴,一起延续这份热忱!

- 来自作者
- 相关推荐